Đề cương ôn tập cuối học kì II môn Hóa học Lớp 9 - Năm học 2020-2021
4. Một hợp chất rượu có công thức C3H7OH. Số công thức cấu tạo của rượu trên là bao nhiêu ?
A. 4 B. 5 C. 3 D. 2
5. Khi phân tích một hiđrocacbon (X) chứa 85,71% cacbon. Công thức phân tử của (X) là
A. C2H6. B. C3H6. C. C2H4. D. C3H8.
6. Tính chất vật lí cơ bản của metan là
A. chất lỏng, không màu, tan nhiều trong nước.
B. chất khí, không màu, tan nhiều trong nước.
C. chất khí, không màu, không mùi, nặng hơn không khí, ít tan trong nước.
D. chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
7. Khi đốt cháy hoàn toàn một thể tích hiđrocacbon X, thu được thể tích khí CO2 bằng thể tích hiđrocacbon X khi đem đốt (trong cùng điều kiện về nhiệt độ và áp suất). Hiđrocacbon đó là
A. C2H2 B. C2H4 C. CH4 D. C3H6
Bạn đang xem tài liệu "Đề cương ôn tập cuối học kì II môn Hóa học Lớp 9 - Năm học 2020-2021", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
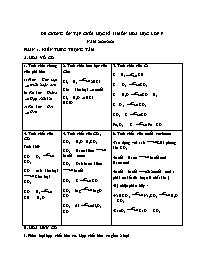
ĐỀ CƯƠNG ÔN TẬP CUỐI HỌC KÌ II MÔN HÓA HỌC LỚP 9 NĂM 2020-2021 PHẦN 1. KIẾN THỨC TRỌNG TÂM HÓA VÔ CƠ 1. Tính chất chung của phi kim a) Pkim + Kim loại muối hoặc oxit b) Phi kim + Hiđro Hợp chất khí c) Phi kim + Oxi Oxit 2. Tính chất hóa học của Clo: Cl2 + H2 2HCl Clo + kim loại muối Cl2 + H2O HCl + HClO 3. Tính chất của C: C + H2 CH4 C + O2 CO2 C + H2O CO + H2 C+ O2 CO2 CO2 + C CO Fe2O3 + C Fe + CO 4. Tính chất của CO Tính khử: CO + O2 CO2 CO + oxit kim loại Kim loại + CO2 CO + H2 CH4 + H2O 5. Tính chất của CO2 CO2 + H2O H2CO3 CO2 + Bazơ kiềm Muối + nước CO2 + Oxit bazơ kiềm Muối CO2 + C CO CO2 + Mg MgO + CO CO2 + Al Al2O3 + CO 6. Tính chất của muối cacbonat -Tác dụng với axit Giải phóng khí CO2 -Muối + Bazơ Muối mới + Bazơ mới -Muối + Muối 2muối mới ( phải có kết tủa hoặc là chất khí ) -Bị nhiệt phân hủy : -NaHCO3 Na2CO3 H2O + CO2 -CacO3 CaO + CO2 B. HÓA HỮU CƠ I. Phân loại hợp chất hữu cơ. Hợp chất hữu cơ gồm 2 loại + Hiđrocacbon: Chỉ chứa 2 nguyên tố là H, C. + Dẫn xuất của hiđrocacbon: Ngòai 2 nguyên tố H, C còn chứa các nguyên tố khác: N, O, Cl,... II. Tính chất của hiđrocacbon. Metan Etilen Axetilen Benzen CT cấu tạo T/c vật lý Chất khí không màu, không mùi,ít tan trong nước Chất lỏng,không màu,thơm, ít tan trong nước. Phản ứng thế CH4 + Cl2 CH3Cl + HCl Không phản ứng Sẽ học ở lớp trên C6H6 + Cl2 C6H5Cl + HCl C6H6 + Br2 C6H5Br + HBr P/ứ cộng Không phản ứng C2H4 + H2 C2H6 C2H4 + Br2 C2H4Br2 C2H2 + H2 C2H4 C2H2 +H2 Pt C2H6 C6H6 + 3Cl2 C6H6Cl6 P/ứ trùng hợp Không phản ứng nCH2=CH2 (-CH2-CH2-)n polietilen(PE) Sẽ học ở lớp trên Không phản ứng P/ứ cháy CH4 + 2O2 à CO2 +2H2O C2H4 + 3O2 2CO2 + 2H2O 2C2H2 + 5O2 4CO2 + 2H2O 2C6H6 + 15O2 12CO2 + 6H2O P/ứ hợp nước Không tham gia C2H4 + H2O C2H5OH Sẽ học ở lớp trên Không tham gia Điều chế CH3COONa + NaOH CH4 + Na2CO3 C2H5OH C2H4 + H2O CaC2 + 2H2O C2H2 + Ca(OH)2 3CH= CH C6H6 ứng dụng -Dùng làm nhiên liệu -Sx bột than, H2, CCl4, .. Kích thích quả mau chín, sx rượu, axit ,PE, .. Dùng làm nhiên liệu, sx PVC, caosu, Làm dung môi, sx thuốc trừ sâu, chất dẻo, II. Tính chất của dẫn xuất hiđrocacbon. 1. Rượu etylic, axit axetic, chất béo. Rượu etylic Axit axetic Chất béo CT cấu tạo (RCOO)3C3H5 R là gốc hiđrocacbon Phản ứng đốt cháy C2H5OH +3O2 2CO2 + 3H2O CH3COOH + 3O2 2CO2 + 2H2O Chất béo (RCOO)3C3H5 + O2 CO2 + H2O. P/ứ thủy phân(tác dụng với nước) Không phản ứng Không phản ứng Chất béo + Nước Glixerin + các axit béo P/ứ với dung dịch kiềm Không phản ứng CH3COOH + NaOH CH3COONa + H2O Chất béo + dd kiềm Glixerin + Các muối của axit béo Phản ứng oxi hóa -khử C2H5OH + O2 CH3COOH + H2O Không phản ứng (C17H35COO)3C3H5 + 3NaOH 3C17H35COOH + C3H5(OH)3 Phản ứng với Na 2C2H5OH + 2Na 2C2H5ONa + H2 2 CH3COOH + 2Na 2CH3COONa + H2 Không phản ứng Phản ứng este hóa CH3COOH + C2H5OH CH3COOC2H5 + H2O CH3COOH + C2H5OH CH3COOC2H5 + H2O Không phản ứng P/ứ với muối của axit yếu hơn Không phản ứng 2 CH3COOH + CaCO3 (CH3COO)2Ca + CO2 + H2O ( Phản ứng này để nhận biết axit CH3COOH) Không phản ứng Điều chế a. (-C6H10O5-)n(tinh bột hoặc xenlulozơ) nC6H12O6 2nC2H5OH +2nCO2. b. C2H4 + H2O C2H5OH a. C2H5OH + O2 CH3COOH b.2C4H10(butan) + 5O2 4CH3COOH + 2H2O. c.Chưng gỗ ( nồi kín) CH3COOH Glixerol + Axit béo Chất béo + nước Ứng dụng Dùng làm rượu bia, nước giải khát, nhiên liệu, nguyên liệu điều chế các chất hữu cơ, Nguyên liệu để tổng hợp chất dẻo,phẩm nhuộm,dược phẩm, Là TP cơ bản trong thức ăn của người và ĐV,cung cấp năng lượng, 2. Glucozơ, Saccarozơ, tinh bột và xenlulozơ. Glucozơ Saccarozơ Tinh bột và xenlulozơ Phản ứng oxi hóa C6H12O6 + Ag2O C6H12O7 + 2Ag (axit gluconic) Không phản ứng Không phản ứng Phản ứng lên men C6H12O6 2C2H5OH + 2CO2 Không phản ứng Không phản ứng Phản ứng thủy phân Không phản ứng C12H22O11 + H2O C6H12O6 ( glucozơ) + C6H12O6 (Fructozơ) (-C6H10O5-)n + nH2O nC6H12O6 Phản ứng với iot Không phản ứng Không phản ứng Hồ tinh bột + Nước iot màu xanh thẫm Điều chế (-C6H10O5-)n + nH2O nC6H12O6 Từ mía Do sự quang tổng hợp trong cây xanh: 6nCO2 + 5nH2O (-C6H10O5-)n + 6nCO2 PHẦN 2. TRẮC NGHIỆM 1. Dãy các chất nào sau đây trong phân tử chỉ có liên kết đơn ? A. CH4, C2H6. B. CH4, C3H6. C. C2H4, C2H6. D. C2H4, CH4. 2. Một hợp chất hữu cơ có công thức C3H7Br , có số công thức cấu tạo là A. 1 B. 2 C.3 D. 4 3. Có các công thức cấu tạo sau, công thức biểu diễn mấy chất A 1. CH3 – CH2 – CH2 – CH2 – CH3 A. 3 chất. B. 2 chất. C. 1 chất. D. 4 chất. 4. Một hợp chất rượu có công thức C3H7OH. Số công thức cấu tạo của rượu trên là bao nhiêu ? A. 4 B. 5 C. 3 D. 2 5. Khi phân tích một hiđrocacbon (X) chứa 85,71% cacbon. Công thức phân tử của (X) là A. C2H6. B. C3H6. C. C2H4. D. C3H8. 6. Tính chất vật lí cơ bản của metan là A. chất lỏng, không màu, tan nhiều trong nước. B. chất khí, không màu, tan nhiều trong nước. C. chất khí, không màu, không mùi, nặng hơn không khí, ít tan trong nước. D. chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước. 7. Khi đốt cháy hoàn toàn một thể tích hiđrocacbon X, thu được thể tích khí CO2 bằng thể tích hiđrocacbon X khi đem đốt (trong cùng điều kiện về nhiệt độ và áp suất). Hiđrocacbon đó là A. C2H2 B. C2H4 C. CH4 D. C3H6 8. Hợp chất hữu cơ nào sau đây chỉ có phản ứng thế với clo, không có phản ứng cộng với clo ? A. C3H6 B. C4H8 C. C2H4 D. CH4 9. Sản phẩm chủ yếu của một hợp chất hữu cơ khi cháy là A. khí nitơ và hơi nước. B. khí cacbonic và khí hiđro. C. khí cacbonic và cacbon. D. khí cacbonic và hơi nước. 10. Cho các chất sau: H2O, HCl, Cl2, O2, Br. Khí metan phản ứng được với A. H2O, HCl B. Cl2, O2 C. HCl, Cl2 D. O2, Br, HCl 11. Để loại bỏ khí axetilen trong hỗn hợp với metan người ta dùng A. khí nito. B. khí hiđro. C. dung dịch brom. D. khí oxi. 12. Trong phân tử etilen giữa hai nguyên tử cacbon có A. một liên kết đơn. B. một liên kết đôi. C. hai liên kết đôi. D. một liên kết ba. 13. Các trái cây, trong quá trình chín sẽ thoát ra một lượng nhỏ chất khí là A. metan. B. etan. C. etilen. D. axetilen. 14. Khí CH4 và C2H4 có tính chất hóa học giống nhau là ( A. tham gia phản ứng thế với dung dịch brom. B. tham gia phản ứng cộng với khí Nito. C. tham gia phản ứng cộng với dung dịch brom. D. tham gia phản ứng cháy với khí oxi sinh ra khí cacbonic và nước. 15. Khí etilen cho phản ứng đặc trưng là A. phản ứng cháy. B. phản ứng thế. C. phản ứng cộng. D. phản ứng trùng ngưng. 16. Khí X có tỉ khối so với hiđro là 15. Khí X A. CH4. B. C3H8. C. C2H6. D. C2H4. 17. Biết 0,02 mol hiđrocacbon X có thể tác dụng tối đa với 100ml dung dịch brom 0,2M. Vậy X là A. C2H4. B. CH4. C. C2H2. D. C2H6. 18. Đốt cháy hoàn toàn 4,48 lít khí etilen ở đktc. Thể tích khí oxi và thể tích không khí cần dùng ở đktc là ( biết rằng khí oxi chiếm 20% thể tích không khí) A. 13,44 lít; 67,2 lít. B. 16,8 lít; 84 lít. C. 6,72 lít; 33,6 lít. D. 3,36 lít; 16,8 lít. 19. Đốt cháy hoàn toàn 5,6 gam khí etilen. Thể tích khí oxi cần dùng ở đktc và khối lượng khí CO2 sinh ra là A. 13,44 lít; 17,6 gam. B. 6,72 lít; 13,2 gam. C. 11,2 lít; 22 gam. D. 5,6 lít; 11 gam. 20. Dẫn 2,8 lít (ở đktc) hỗn hợp khí metan và etilen đi qua bình đựng dung dịch brom dư thấy có 4 gam brom đã phản ứng. Thành phần phần trăm về thể tích các khí trong hỗn hợp lần lượt là A. 50 % ; 50%. B. 40 % ; 60%. C. 30 % ; 70%. D. 80 % ; 20%. 21. Đốt cháy hoàn toàn 25 cm3 một hỗn hợp gồm metan và etilen thì cần 60 cm3 oxi ( các khí đo ở đktc). Thành phần phần trăm theo thể tích các khí trong hỗn hợp ban đầu lần lượt là (chương 4/ bài 37/ mức 3) A. 60% ; 40%. B. 50% ; 50%. C. 40% ; 60%. D. 30% ; 70%. 22. Nhiệt độ sôi của rượu etylic là A. 78,30C. B. 7,30C. C. 73,50C. D. 73,70C. 23. Trong 100 ml rượu 550 có chứa A. 55 ml nước và 45 ml rượu nguyên chất. B. 55 ml rượu nguyên chất và 45 ml nước. C. 55 gam rượu nguyên chất và 45 gam nước. D. 55 gam nước và 45 gam rượu nguyên chất. 24. Nhóm –OH trong phân tử rượu etylic có tính chất hóa học đặc trưng là A. tác dụng được với kim loại giải phóng khí hiđro. B. tác dụng được với natri, kali giải phóng khí hiđro. C.tác dụng được với magie, bạc giải phóng khí hiđro. D. tác dụng được với đồng, sắt giải phóng khí hiđro. 25. Cho 5,6 lít khí etilen ( đktc) tác dụng với nước có axit sunfuric ( H2SO4) làm xúc tác, thu được 4,6 gam rượu etylic. Hiệu suất phản ứng là A. 44,4%. B. 45,6 %. C. 66,7%. D. 55,8 %. 26. Rượu etylic có khả năng hòa tan trong nước hơn metan, etilen là do A. trong phân tử rượu etylic có 2 nguyên tử cacbon. B. trong phân tử rượu etylic có 6 nguyên tử hiđro. C. trong phân tử rượu etylic có nhóm – OH. D. trong phân tử rượu etylic có 2 nguyên tử cacbon và 6 nguyên tử hiđro. 27. Đốt cháy dẫn xuất của hidrocacbon X, chứa 1 nguyên tử oxi theo sơ đồ sau: X + 3O2 à 2CO2 + 3H2O X là A. C2H4O. B. C2H6O. C. C3H8O. D. C3H6O. 28. Hòa tan một mẫu natri dư vào rượu etylic nguyên chất thu được 2,24 lít khí H2 ( đktc). Thể tích rượu etylic đã dùng là (Biết khối lượng riêng của rượu etylic là D= 0,8g/ml) A. 11,0 ml. B. 11,5 ml. C. 12,0 ml. D. 12,5 ml. 29. Giấm ăn là dung dịch axit axetic có nồng độ (Chương 5/ bài 45/ mức 1) A. trên 5%. B. dưới 2%. C. từ 2% - 5%. D. từ 3% - 6%. 30. Trong công nghiệp một lượng lớn axit axetic được điều chế bằng cách A. oxi hóa metan có xúc tác và nhiệt độ thích hợp. B. oxi hóa etilen có xúc tác và nhiệt độ thích hợp. C. oxi hóa etan có xúc tác và nhiệt độ thích hợp. D. oxi hóa butan có xúc tác và nhiệt độ thích hợp. men giấm 31. Phản ứng lên men giấm là men giấm A. C2H6O + H2O CH3COOH + H2O. men giấm B. C2H5OH CH3COOH + H2O. men giấm C. C2H5OH + O2 CH3COOH. D. C2H5OH + O2 CH3COOH + H2O. 32. Cặp chất tồn tại được trong một dung dịch là ( không xảy ra phản ứng hóa học với nhau) A. CH3COOH và NaOH. B. CH3COOH và H3PO4. C. CH3COOH và Ca(OH)2. D. CH3COOH và Na2CO3. 33. Cho 100 ml dung dịch CH3COOH 0,1M vào 100 ml dung dịch Ca(OH)2 0,1M. Dung dịch sau phản ứng có khả năng A. làm quỳ tím hóa xanh. B. làm quỳ tím hóa đỏ. C. không làm quỳ tím đổi màu. D. tác dụng với Mg giải phóng khí H2. 34. Cho dung dịch chứa 10 gam CH3COOH tác dụng với dung dịch chứa 10 gam KOH. Sau khi phản ứng hoàn toàn dung dịch chứa các chất tan là A. CH3COOK và KOH. B. CH3COOK và CH3COOH. C. CH3COOK. D. CH3COOK, CH3COOH và KOH. 35. Cho axit axetic tác dụng với rượu etylic có mặt H2SO4 đặc làm xúc tác và đun nóng. Sau phản ứng thu được 44 gam etyl axetat. Khối lượng CH3COOH và C2H5OH đã phản ứng là A. 60 gam và 46 gam. B. 30 gam và 23 gam. C. 15 gam và 11,5 gam. D. 45 gam và 34,5 gam. 36. Hòa tan hoàn toàn 13 gam Zn vào dung dịch CH3COOH. Thể tích khí H2 thoát ra ( đktc) là A. 0,56 lít. B. 4,48 lít. C. 2,24 lít. D. 3,36 lít. 37. Cho 30 gam axit axetic CH3COOH tác dụng với rượu etylic dư có mặt H2SO4 đặc làm xúc tác (hiệu suất 100%). Khối lượng etyl axetat tạo thành là A. 33 gam. B. 44 gam. C. 55 gam. D. 66 gam. 38. Hòa tan 20 gam CaCO3 vào dung dịch CH3COOH dư. Thể tích CO2 thoát ra ( đktc) là A. 2,24 lít. B. 3,36 lít. C. 4,48 lít. D. 5,60 lít. 39. Cho dung dịch chứa10 gam hỗn hợp C2H5OH và CH3COOH tác dụng với Zn dư thu được 1,12 lít khí H2 (đktc) . Thành phần phần trăm theo khối lượng của rượu etylic và axit axetic lần lượt là A. 30% và 70%. B. 40% và 60%. C. 70% và 30%. D. 60% và 40%. 40. Chọn câu đúng trong các câu sau A. Những chất có nhóm –OH và nhóm –COOH tác dụng được với KOH. B. Những chất có nhóm –OH tác dụng được với K. C. Những chất có nhóm –COOH tác dụng với KOH nhưng không tác dụng với K. D. Những chất có nhóm –OH và nhóm –COOH cùng tác dụng với K và KOH. 41. Cho sơ đồ sau: CH2 = CH2 + H2O X X + O2 Y + H2O X + Y CH3COO-C2H5 + H2O X, Y là A. C2H6, C2H5OH. B. C2H5OH, CH3COONa. C. C2H5OH, CH3COOH. D. C2H4, C2H5OH. 42. Thủy phân chất béo trong môi trường axit thu được A. glixerol và một loại axit béo. B. glixerol và một số loại axit béo. C. glixerol và một muối của axit béo. D. glixerol và xà phòng 43. Thủy phân chất béo trong môi trường kiềm thu được A. glixerol và muối của một axit béo. B. glixerol và axit béo. C. glixerol và xà phòng. D. glixerol và muối của các axit béo 44. Chất nào sau đây không phải là chất béo? A. (C17H35COO)3C3H5. B. (C15H31COO)3C3H5. C. (C17H33COO)3C3H5. D. (CH5COO)3C3H5. 45. Một chất béo có công thức (C17H35COO)3C3H5 có phân tử khối là A. 890 đvC. B. 423 đvC. C. 372 đvC. D. 780 đvC. 46. Hãy chọn phương trình hoá học đúng khi đun một chất béo với nước có axit làm xúc tác A. (RCOO)3C3H5 + 3H2O C3H5(OH)3 + 3RCOOH B. (RCOO)3C3H5 + 3H2O 3C3H5OH + R(COOH)3 C. 3RCOOC3H5 + 3H2O 3C3H5OH + 3R-COOH D. RCOO(C3H5)3 + 3H2O 3C3H5OH + R-(COOH)3 47. Tính khối lượng (C17H35COO)3C3H5 tối thiểu để điều chế 1 tấn C17H35COONa dùng làm xà phòng, biết rằng hiệu suất phản ứng là 80%. (chương 5/ bài 47 / mức 3) A. 1,2 tấn. B. 1,25 tấn. C. 1,3 tấn. D. 1,212 tấn. 48. Có ba lọ không nhãn đựng : rượu etylic, axit axetic, dầu ăn. Có thể phân biệt bằng cách nào sau đây ? A. Dùng quỳ tím và nước. B. Khí cacbon đioxit và nước. C. Kim loại natri và nước. D. Phenolphtalein và nước. 49. Ba gói bột màu trắng là glucozơ, tinh bột và saccarozơ. Có thể nhận biết bằng cách nào sau đây ? A. Dung dịch brom và Cu(OH)2. B. Dung dịch NaOH và dung dịch iot. C. Hoà tan vào nước và dung dịch HCl. D. Hoà tan vào nước và cho phản ứng với dung dịch AgNO3/NH3. 50. Phản ứng tráng gương là A. 2CH3COOH + Ba(OH)2 (CH3COO)2Ba + 2 H2O. B. C2H5OH + K C2H5OK + H2 C. C6H12O6 2C2H5OH + 2CO2 D. C6H12O6 + Ag2O C6H12O7 + 2Ag 51. Lên men rượu từ glucozơ sinh ra 4,48 lít khí cacbonic ở đktc. Lượng natri cần lấy để tác dụng hết với lượng rượu sinh ra là A. 46 gam. B. 2,3 gam. C. 6,4 gam. D. 4,6 gam. 52. Chọn câu đúng nhất. A. Tinh bột và xenlulozơ dễ tan trong nước. B. Tinh bột dễ tan trong nước còn xenlulozơ không tan trong nước. C. Tinh bột và xenlulozơ không tan trong nước lạnh nhưng tan trong nước nóng. D. Tinh bột không tan trong nước lạnh nhưng tan một phần trong nước nóng. Còn xenlulozơ không tan cả trong nước lạnh và nước nóng. 53. Loại tơ có nguồn gốc từ xenlulozơ là A. tơ tằm, bông vải. B. tơ tằm, sợi đay. C. bông vải, sợi đay. D. tơ tằm, tơ nilon-6,6. 54. Trong phản ứng quang hợp tạo thành tinh bột của cây xanh thì A. số mol H2O bằng số mol CO2. B. số mol H2O bằng số mol tinh bột. C. số mol CO2 bằng số mol O2. D. số mol CO2 bằng số mol tinh bột. 55. Dấu hiệu để nhận biết protein là A. làm dung dịch iot đổi màu xanh. B. có phản ứng đông tụ trắng khi đun nóng. C. thủy phân trong dung dịch axit. D. đốt cháy có mùi khét và có phản ứng đông tụ khi đun nóng. 56. Aminoaxit (A) chứa 13,59% nitơ về khối lượng. Công thức phân tử của aminoaxit là A. C3H7O2N. B. C4H9O2N. C. C5H11O2N. D. C6H13O2N. 57. Monome nào sau đây tham gia phản ứng trùng hợp để tạo ra PE? A. Metan. B. Etilen. C. Axetilen. D. Vinyl clorua. 58. Để thu được 1 tấn PVC thì khối lượng vinyl clorua cần dùng là (Hiệu suất phản ứng là 90%) A. 1 tấn. B. 0,9 tấn. C. 0,1 tấn. D. 1,11 tấn 59. Trùng hợp 0,5 tấn etilen với hiệu suất 90 % thì khối lượng polietilen thu được là (Chương 5/ bài 54/ mức 3) A. 0,5 tấn. B. 5 tấn. C. 4,5 tấn. D. 0,45 tấn. 60. Đốt cháy hết x gam C2H5OH thu được 0,25 mol CO2. Đốt cháy hết y gam CH3COOH thu được 0,25 mol CO2. Cho x gam C2H5OH tác dụng với y gam CH3COOH (giả sử hiệu suất phản ứng là 100%). Khối lượng este thu được là A. 9 gam. B. 10 gam. C. 11 gam. D. 12 gam. PHẦN 3. TỰ LUẬN 1. Viết các PTHH biểu diễn các chuyển đổi hóa học sau (ghi rõ điều kiện nếu có) a/ S SO2 SO3 H2SO4 b/ C CO2 CaCO3 CO2 CO c/ C2H4 C2H5OH CH3COOH CH3COOC2H5 CH3COONa (7) Natri axetat. (8) d/ Glucozơ Rượu Êtylic Axit axetic Etyl axetat. e/ C2H5OH C2H4 C2H5Cl C2H5OH (14) (15) f/ C2H4 C2H5OHCH3COOH (CH3COO)2 Zn CH3COOC2H5 g/ Tinh bột Glucozơ Rượu etylic Etyl axetat Natri axetat Mê tan h/ FeCl3Cl2NaClO (8) (6) i/ đá vôivôi sốngđất đènaxetylenetylen P.E PVCCH2 = CHCl Rượu etylic 2. Bằng phương pháp hóa học hãy nhận biết 3 bình đựng các khí không màu sau: C2H2, CO2, CH4. 3. Bằng phương pháp hóa học hãy phân biệt 3 chất lỏng sau: benzen, rượu etylic, axit axetic. 4. Bằng phương pháp hóa học hãy phân biệt các chất lỏng sau: CH3COOH, C2H5OH, CH3COOC2H5. 6. Bằng phương pháp hóa học hãy phân biệt các chất sau: C2H5OH, C6H12O6, C12H22O11 7. Bằng phương pháp hóa học hãy phân biệt các chất sau: hồ tinh bột, glucozo và saccarozo 8. Khi cho 2,8 lít hỗn hợp khí CH4, C2H4 đi qua bình đựng nước brom, thấy có 4g brom tham gia phản ứng a. Tính khối lượng sản phẩm tạo thành sau phản ứng. b. Tính thành phần phần trăm về thể tích của các khí trong hỗn hợp ban đầu, biết phản ứng xảy ra hoàn toàn, các khí đo ở điều kiện tiêu chuẩn. 9. Đốt cháy 3,36 lít khí etylen cần phải dùng: a. Bao nhiêu lít khí oxi? b. Bao nhiêu lít không khí chứa 20% thể tích oxi?( các chất khí đo ở điều kiện tiêu chuẩn) c. Dẫn toàn bộ sản phẩm qua bình đựng nước vôi trong dư, tính khối lượng kết tủa thu được sau phản ứng. 10. Khi lên men glucozo người ta thu được 5,6 lít khí cacbonic ở đktc. a. Tính khối lượng rượu etylic sau khi lên men. b. Tính lượng glucozo đã dùng lúc đầu, biết hiệu suất của quá trình lên men là 95%. Đáp án phần trắc nghiệm đề cương ôn tập học kì 2 Hóa 9 1 2 3 4 5 6 7 8 9 10 A B C D B D D D D B 11 12 13 14 15 16 17 18 19 20 C B C D C C A A A D 21 22 23 24 25 26 27 28 29 30 A A B B C C B B C C 31 32 33 34 35 36 37 38 39 40 D B A A B C B C B B 41 42 43 44 45 46 47 48 49 50 C D D D A A D A D D 51 52 53 54 55 56 57 58 59 60 D D C C D B B A D C
Tài liệu đính kèm:
 de_cuong_on_tap_cuoi_hoc_ki_ii_mon_hoa_hoc_lop_9_nam_hoc_202.doc
de_cuong_on_tap_cuoi_hoc_ki_ii_mon_hoa_hoc_lop_9_nam_hoc_202.doc






