Giáo án Đề thi học kì I hoá học lớp 8
Câu Hỏi :
Câu 1 ( 1 điểm) Nguyên tử là gì ? Nguyên tử gồm những thành phần nào ?
Câu 2 (1điểm ) Hãy tính khối lượng bằng gam của nguyên tử Fe biết một đơn vị cacbon bằng 1,66 x 10-24 gam
Câu 3(2điểm ) Lập công thức hóa học của các hợp chất sau: Ca(II) và nhóm PO4(III). Al (III) và O
Bạn đang xem tài liệu "Giáo án Đề thi học kì I hoá học lớp 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
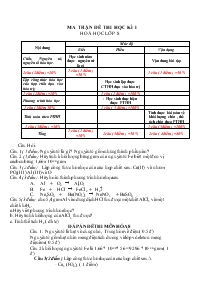
MA TRẬN ĐỀ THI HỌC KÌ I HOÁ HỌC LỚP 8 Nội dung Mức độ Biết Hiểu Vận dụng Chất, Nguyên tử, nguyên tố hóa học. Học sinh nắm được nguyên tử là gì Vận dung bài tập 2câu ( 2điểm ) =20% 1 câu ( 1 điểm ) =50 % 1 câu ( 1 điểm ) =50 % Lập công thức hóa học của hợp chất dựa vào hóa trị; Học sinh lập được CTHH dựa vào hóa trị 1 câu ( 2điểm ) =20% 1 câu ( 2 điểm ) =100 % Phương trình hóa học - Học sinh thực hiện được PTHH 1 câu ( 3điểm 30%) 1 câu ( 3 điểm ) =100% Tính toán theo PTHH Tính được bài toán về khối lượng chất , thể tích chất theo PTHH 1 câu ( 3điểm ) =30% 1 câu ( 3điểm ) =100% Tổng 1 câu ( 1 điểm ) =10% 2câu ( 5điểm ) =50 % 2câu ( 4điểm ) =40% Câu Hỏi : Câu 1 ( 1 điểm) Nguyên tử là gì ? Nguyên tử gồm những thành phần nào ? Câu 2 (1điểm ) Hãy tính khối lượng bằng gam của nguyên tử Fe biết một đơn vị cacbon bằng 1,66 x 10-24 gam Câu 3(2điểm ) Lập công thức hóa học của các hợp chất sau: Ca(II) và nhóm PO4(III). Al (III) và O Câu 4 (3điểm ): Hãy hoàn thành phương trình hóa học sau A. Al + O2 4 Al2O3 B. Fe + HCl 4 FeCl2 + H2 C. Na2SO4 + Ba(NO3)2 4 NaNO3 + BaSO4 Câu 5(3điểm) cho 5,4 gam Al vào dung dịch HCl thu được một chất AlCl3 và một chất khí H2. a.Hãy viết phương trình hóa học? b. Hãy tính khối lượng của AlCl3 thu được? c. Tính thể tích H2 ( dktc) ĐÁP ÁN ĐỀ THI MÔN HÓA 8 Câu 1 : Nguyên tử là hạt vô cùng nhỏ , Trung hòa về điện ( 0.5 đ) Nguyên tử gổm hạt nhân mang điện tích dương và lớp vỏ eleton mang điện âm( 0.5 đ ) Câu 2 khối lượng nguyên tử Fe là 1.66 * 10-24 * 56 = 92.96 *10- 24 gam ( 1 đ) Câu 3(2điểm ) Lập công thức hóa học của các hợp chất sau:). - Ca3 (PO4)2 ( 1 điểm) - Al2 O3 ( 1 điểm) Câu 4 ( 3 điểm) A. 4Al + 3 O2 → 2 Al2O3 B. Fe + 2HCl → FeCl2 + H2 C. Na2SO4 + Ba(NO3)2 " 2NaNO3 + BaSO4 Câu 5 ( 3 điểm ) a. ( 1 điểm) Phương trình hóa học 2Al + 6HCl → 2AlCl3 + 3H2 b. ( 1 điểm) Số mol của Al là n = m/M = 5.4/27= 0.2 mol - Theo PTHH số mol Al = AlCl3 = 0.2 mol - Khối lượng AlCl3 là m = n * M = 0.2 *133.5= 27.6 gam c. ( 1 điểm)Theo phương trình số mol H2 = 3/2 Al = 0.3 mol Thể tích H2 là V= n *22.4 =0.3 22.4 = 6.72 lít MA TRẬN ĐỀ KIỂM TRA HÓA HỌC 9 HỌC KÌ I NĂM HỌC 2011 – 2011 Chủ đề Nhận biết Thông hiểu Vận dụng Cộng Chủ đề 1: Các loại hợp chất vô cơ Tính chất hóa học của axit? Viết phương trình phản ứng? Viết các PTHH biểu diễn sơ đồ chuyển hóa giữa các loại hợp chất vô cơ. . Số câu: Số điểm : 1 câu 2,5 đ 1 câu 2đ 2 câu 4,5 Chủ đề 2:Kim loại : Dãy hoạt động hóa học ,sắt - dãy hoạt động hoá học của kim loại. Phương trình phản ứng - Tìm khối lượng , nồng độ, các chất tham gia phản ứng và tạo thành sau phản ứng Số câu: Số điểm: 1 câu 0.5 đ 0.25 câu 1đ 0.75 câu 2đ 2 câu 3.5đ Chủ đề 3 :Phi kim Điều chế Clo Số câu: Số điểm: 1 câu 2đ 1 câu 2đ Tổng số câu Tổng số điểm Tỉ lệ 3 câu 5đ 50% 1,25 câu 3 đ 30% 1,75 câu 2 đ 40% 5 câu 10 đ 100% Trường THPT U Minh Thương Họ và tên: Lớp Kiểm tra HKI – Năm học 2011 – 2012 Môn hóa học 9 Thời gian: 45 phút Câu 1: (2,5đ) Trình bày tính chất hóa học chung của axit ? Viết phương trình phản ứng minh họa? Câu 2: (2đ) Viết phương trình hóa học cho chuyển đổi hóa học sau: CuO CuCl2 Cu(OH)2 CuO Cu Câu 3: (0.5đ) Viết dãy hoạt động hóa học của một số kim loại ? Câu 4: (2đ) Viết phương trình phản ứng điếu chế Clo trong phòng thí nghiệm và trong công nghiệp Câu 5: (3đ) Cho một lượng bột sắt dư vào 50 ml dung dịch axit sunfuric (H2SO4).Phản ứng xong thu được 3,36 lít khí hiđro (H2) ở điều kiện tiêu chuẩn. Viết phương trình phản ứng? Tính khối lượng sắt tham gia phản ứng ? Tính nồng độ mol của dung dịch axit sunfuric(H2SO4 ) ? Tính khối lượng muối Sắt (II)sunfat (FeSO4) tạo thành ? (Cho O=16 , Fe=56 , S=32 , H=1) ĐÁP ÁN VÀ THANG ĐIỂM Câu Đáp án Thang điểm 1 - Làm đổi màu quì tím - Tác dụng với kim loại PTPƯ - Tác dụng với oxit bazơ PTPƯ - Tác dụng với bazơ PTPƯ - Tác dụng với muối PTPƯ 0.5đ 0.5đ 0.5đ 0.5đ 0.5đ 2 CuO +2 HCl CuCl2 + H2 CuCl2 + 2NaOH Cu(OH)2 + 2NaCl Cu(OH) 2 CuO + H2O CuO + H 2 Cu + H2O 0.5đ 0.5đ 0.5đ 0.5đ 3 K, Na, Mg, Al, Zn, Fe, Pb, H, Cu, Ag,Au 0.5đ 4 4 HCl +MnO2 Đun nhẹ MnCl2 + Cl + 2 H2O 2 NaCl + 2 H2O Điện phân có màng ngăn Cl2 + H2 + 2 NaOH 1đ 1đ 5 a) nH2 = 3,36 : 22,4 = 0,15(mol) Phương trình hóa học: Fe(r) + H2SO4(dd) FeSO4(dd) + H2(k) 1 mol 1 mol 1 mol 1 mol ? mol ? mol ? mol 0,15 mol Theo PTHH: nFe = nH2 = 0,15 (mol) => mFe = 56 . 0,15 = 8,4(g) 0.5đ 1đ 0.25đ 0.25đ b) Theo PTHH: nH2SO4 = nH2 = 0,15(mol) => CM = 0,15 : 0,05 = 3 (M) 0.25đ 0.25đ c) Theo PTHH: nFeSO4 = 0,15 (mol) mFeSO4 = 0,15.(56+32+16.4) = 22,8 (g) 0.25đ 0.25đ
Tài liệu đính kèm:
 de thi hoa THCS 2011 2012.doc
de thi hoa THCS 2011 2012.doc





