Giáo án lớp 9 môn Hóa học - Chủ đề 2: Sơ đồ phản ứng ( phần vô cơ )
1/ Các bước thực hiện:
- Phân loại các nguyên liệu và sản phẩm ở mỗi mũi tên.
- Chọn các phản ứng thích hợp để biến các nguyên liệu thành các sản phẩm.
- Viết đầy đủ các phương trình hóa học ( ghi điều kiện nếu có ).
* Lưu ý :
+ ) Trong sơ đồ biến hoá : mỗi mũi tên chỉ được viết một PTHH
Bạn đang xem 20 trang mẫu của tài liệu "Giáo án lớp 9 môn Hóa học - Chủ đề 2: Sơ đồ phản ứng ( phần vô cơ )", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
Chủ đề 2: SƠ ĐỒ PHẢN ỨNG
( Phần vô cơ )
I- KIẾN THỨC CẦN NHỚ
1/ Các bước thực hiện:
- Phân loại các nguyên liệu và sản phẩm ở mỗi mũi tên.
- Chọn các phản ứng thích hợp để biến các nguyên liệu thành các sản phẩm.
- Viết đầy đủ các phương trình hóa học ( ghi điều kiện nếu có ).
* Lưu ý :
+ ) Trong sơ đồ biến hoá : mỗi mũi tên chỉ được viết một PTHH.
+ ) Trong mỗi sơ đồ thì các chữ cái giống nhau là các chất giống nhau ( dạng bổ túc pư )
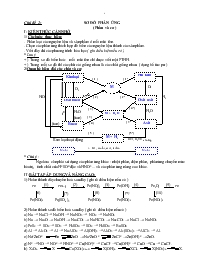
2/Quan hệ biến đổi các chất vô cơ:
H2
( 4’ )
Phi kim
Oxit axit
Axit
M + H2
M
M + H2O
Kim loại
Oxit bazơ
Bazơ
O2
O2
H2O
H2O
( 1 )
( 1’ )
( 2 )
( 2’ )
( 3 )
( 3 )
( 3’ )
( 4 )
( 5 )
(5’)
Muối
Muối
+ Kl , muối, axit, kiềm
H2O
Kim loại hoạt động
HCl, H2SO4 loãng
t0
(tan)
(tan)
* Chú ý :
Ngoài ra còn phải sử dụng các phản ứng khác : nhiệt phân, điện phân, phản ứng chuyển mức hóa trị, tính chất của H2SO4 đặc và HNO3 ... và các phản ứng nâng cao khác.
II- BÀI TẬP ÁP DỤNG VÀ NÂNG CAO:
1) Hoàn thành dãy chuyển hoá sau đây ( ghi rõ điều kiện nếu có ):
Fe
FeCl3
Fe(NO3)3
Fe(OH)3
Fe2O3
Fe2(SO4)3
Fe(NO3)2
Fe(NO3)3
Fe(NO3)3
Fe(NO3)3
(1)
(2)
(3)
(4)
(7)
(6)
(8)
(9)
(10)
Fe
(5)
2) Hoàn thành sơ đồ biến hoá sau đây ( ghi rõ điều kiện nếu có ):
a) Na ® NaCl ® NaOH ® NaNO3 ® NO2 ® NaNO3.
b) Na ® Na2O ® NaOH ® Na2CO3 ® NaHCO3 ® Na2CO3 ® NaCl ® NaNO3.
c) FeS2 ® SO2 ® SO3 ® H2SO4 ® SO2 ® H2SO4 ® BaSO4.
d) Al ® Al2O3 ® Al ® NaAlO2 ® Al(OH)3 ®Al2O3 ® Al2(SO4)3 ® AlCl3 ® Al.
e) Na2ZnO2 Zn ZnO ® Na2ZnO2 ZnCl2 ® Zn(OH)2 ® ZnO.
g) N2 ® NO ® NO2 ® HNO3 ® Cu(NO3)2 ® CuCl2 ® Cu(OH)2 ® CuO ® Cu ® CuCl2.
h) X2On X Ca(XO2)2n – 4 X(OH)n XCln X(NO3)n X.
3) Hoàn thành sơ đồ chuyển hoá sau đây:
+ CO
t0
+ CO
t0
+ CO
t0
+ S
t0
+ O2
t0
+ O2
t0,xt
+ H2O
+ E
H
G
G
F
E
F.
D
B
Fe2O3
A
Hướng dẫn :
Các chất A,B bị khử bởi CO nên phải là các oxit ( mức hoá trị Fe < III) và D phải là Fe.
F và G là các sản phẩm của sự oxi hoá nên phải là các oxit.
Chọn các chất lần lượt là : Fe3O4, FeO, Fe, FeS, SO2, SO3, H2SO4.
4) Xác định các chữ cái trong sơ đồ phản ứng và viết PTHH xảy ra:
a) X1 + X2 ® Br2 + MnBr2 + H2O
b) X3 + X4 + X5 ® HCl + H2SO4
c) A1 + A2 ® SO2 + H2O
d) B1 + B2 ® NH3 + Ca(NO3)2 + H2O
e) D1 + D2 + D3 ® Cl2 + MnSO4 + K2SO4 + Na2SO4 + H2O
Hướng dẫn :
Dễ thấy chất X1,X2 : MnO2 và HBr.
Chất X3 ® X5 : SO2, H2O , Cl2.
Chất A1,A2 : H2S và O2 ( hoặc S và H2SO4 đặc )
Chất B1, B2 : NH4NO3 và Ca(OH)2.
Chất D1, D2,D3 : KMnO4 , NaCl, H2SO4 đặc.
5) Hoàn thành sơ đồ phản ứng sau đây :
SO2 muối A1
A A3
Kết tủa A2
Biết A là hợp chất vô cơ , khi đốt cháy 2,4gam A thì thu được 1,6 gam Fe2O3 và 0,896 lít khí sunfurơ ( đktc).
Hướng dẫn :
Trong 2,4 gam A có : 1,12 gam Fe ; 1,28 gam S Þ không có oxi
Xác định A : FeS2 ( được hiểu tương đối là FeS. S )
Các phương trình phản ứng :
4FeS2 + 11O2 2Fe2O3 + 8SO2
SO2 + 2NaOH ® Na2SO3 + H2O
FeS2 + 2HCl ® FeCl2 + H2S + S ¯ ( xem FeS2 Û FeS.S )
Na2SO3 + S ® Na2S2O3 ( làm giảm hóa trị của lưu huỳnh )
6) Hoàn thành sơ đồ phản ứng sau đây:
(2)
(3)
(6)
SO3 H2SO4
a) FeS2 SO2 SO2 S ¯
NaHSO3 Na2SO3
NaH2PO4
b) P ® P2O5 ® H3PO4 Na2HPO4
Na3PO4
c) BaCl2 + ? ® KCl + ? ( 5 phản ứng khác nhau )
7) Xác định các chất ứng với các chữ cái A, B, C, D, E ... và viết phương trình phản ứng.
a) A B + CO2 ; B + H2O ® C
C + CO2 ® A + H2O ; A + H2O + CO2 ® D
D A + H2O + CO2
b) FeS2 + O2 ® A + B ; G + KOH ® H + D
A + O2 ® C ; H + Cu(NO3)2 ® I + K
C + D ® axit E ; I + E ® F + A + D
E + Cu ® F + A + D ; G + Cl2 + D ® E + L
A + D ® axit G
c) N2 + O2 A ; C + CaCO3 ® Ca(NO3)2 + H2O + D
A + O2 ® B ; D + Na2CO3 + H2O E
B + H2O ® C + A ; E Na2CO3 + H2O + D
(1)
(2)
(3)
(4)
(8)
(5)
(6)
(7)
A
B
C
D
E
H2S
d)
( Biết ở sơ đồ d : A,B,C,D,E là các hợp chất khác nhau của lưu huỳnh ).
Hướng dẫn :
(1) : H2S + 2NaOH ® Na2S + 2H2O
(2): Na2S + FeCl2 ® FeS ¯ + 2NaCl
(3): FeS + H2SO4 ® FeSO4 + H2S
(4): 3FeSO4 + 3/2Cl2 ® Fe2(SO4)3 + FeCl3
(5): Fe2(SO4)3 + 3H2O 2Fe + 3H2SO4 + 3/2 O2
(6): H2SO4 + K2S ® K2SO4 + H2S
(7): FeS + 2HCl ® FeCl2 + H2S
(8): H2SO4 + FeO ® FeSO4 + H2O
Có thể giải bằng các phương trình phản ứng khác.
8) Hoàn thành dãy chuyển hoá sau :
a) CaCl2 ® Ca ® Ca(OH)2 ® CaCO3 Ca(HCO3)2
Clorua vôi Ca(NO3)2
b) KMnO4 Cl2 ® NaClO ® NaCl ® NaOH ® Javel ® Cl2
O2 KClO3
9) Xác định các chất A,B,C,D,E ,G,X, và hoàn thành các phương trình phản ứng:
Fe + A ® FeCl2 + B ; D + NaOH ® E ¯ + G
B + C ® A ; G + H2O ® X + B + C
FeCl2 + C ® D
10) Thay các chữ cái bằng các CTHH thích hợp và hoàn thành phản ứng sau:
A + H2SO4 ® B + SO2 + H2O ; D + H2 A + H2O
B + NaOH ® C + Na2SO4 ; A + E ® Cu(NO3)2 + Ag ¯
C D + H2O
Hướng dẫn : A: Cu ; B: CuSO4 ; C: Cu(OH)2 ; D: CuO ; E: AgNO3
11) Hãy chọn 2 chất vô cơ X khác nhau và xác định A,B,C,D,E,F thỏa mãn sơ đồ sau :
AC E
X X X X ( Hướng dẫn : X là chất bị nhiệt phân hoặc điện phân)
BD F
12) a) Hoàn thành sơ đồ phản ứng sau ( mỗi chữ cái là một chất khác nhau, với S là lưu huỳnh )
S + A X ; S + B Y
Y + A X + E ; X + Y S + E
X + D + E U + V ; Y + D + E U + V
b) Cho từng khí X,Y trên tác dụng với dung dịch Br2 thì đều làm mất màu dung dịch brom. Viết các phương trình hóa học xảy ra.
Hướng dẫn :
X và Y là những chất tạo ra từ S nên chỉ có thể : SO2, H2S , muối sunfua kim loại, sunfua cacbon. Nhưng vì X tác dụng được với Y nên phù hợp nhất là : X ( SO2) và Y ( H2S).
Các phương trình phản ứng:
S + O2 SO2 ( X)
H2S + O2 SO2 + H2O ( E)
SO2 + Cl2 + 2H2O H2SO4 + 2HCl ( U: H2SO4 và V : HCl )
S + H2 H2S ( Y)
SO2 + 2H2S 3S ¯ + 2H2O
H2S + 4Cl2 + 4H2O H2SO4 + 8HCl
13) Xác định các chất A,B, ... M,X trong sơ đồ và viết PTHH để minh họa:
Fe
X + A F
X + B HF
X + C K H + BaSO4 ¯
X + D XH
Hướng dẫn : A,B,C,D phải là các chất khử khác nhau, X là oxit của sắt.
14) Viết PTHH để thực hiện sơ đồ chuyển hóa sau ( mỗi chữ cái là một chất khác nhau)
A B C D A D E A
Biết trong hợp chất oxit, nguyên tố A có chiếm 52,94% về khối lượng.
15) Hoàn thành sơ đồ chuyển hóa sau:
FeCl2 Fe(NO3)2 Fe(OH)2
Fe Fe2O3Fe.
FeCl3 Fe(NO3)2 Fe(OH)3
16) Cho sơ đồ phản ứng sau đây :
NH3 A1 A2
Biết A1 gồm các nguyên tố C,H,O,N với tỷ lệ khối lượng tương ứng 3:1:4:7 và trong phân tử A1 có 2 nguyên tử nitơ.
a) Hãy xác định CTHH của A1, A2, A3 và hoàn thành phương trình phản ứng trên.
b) Chọn chất thích hợp để làm khô mỗi khí A3 và A4.
Hướng dẫn : từ tỷ số khối lượng C,H,O,N tìm được A1 là urê : CO(NH2)2
-------------------------
Chủ đề 3 : ĐIỀU CHẾ CÁC CHẤT VÔ CƠ
I- KIẾN THỨC CẦN NHỚ
1) Phương pháp chung:
B1: Phân loại các nguyên liệu, các sản phẩm cần điều chế.
B2: Xác định các quy luật pư thích hợp để biến các nguyên liệu thành sản phẩm.
B3: Điều chế chất trung gian ( nếu cần )
B4: Viết đầy đủ các PTHH xảy ra.
2- Tóm tắt phương pháp điều chế:
TT
Loại chất
cần điều chế
Phương pháp điều chế ( trực tiếp)
1
Kim loại
1) Đối với các kim loại mạnh ( từ K ® Al):
+ Điện phân nóng chảy muối clorua, bromua
2RClx 2R + xCl2
+ Điện phân oxit: ( riêng Al)
2Al2O3 4Al + 3O2
2) Đối với các kim loại TB, yếu ( từ Zn về sau):
+) Khử các oxit kim loại ( bằng : H2, CO , C, CO, Al )
+ ) Kim loại + muối ® muối mới + kim loại mới.
+ ) Điện phân dung dịch muối clorua, bromua
2RClx 2R + xCl2
( nước không tham gia pư )
2
Oxit bazơ
1 ) Kim loại + O2 oxit bazơ.
2) Bazơ KT oxit bazơ + nước.
3 ) Nhiệt phân một số muối:
Vd: CaCO3 CaO + CO2
3
Oxit axit
1) Phi kim + O2 oxit axit.
2) Nhiệt phân một số muối : nitrat, cacbonat, sunfat
Vd: CaCO3 CaO + CO2
3) Kim loại + axit ( có tính oxh) :® muối HT cao
Vd: Zn + 4HNO3 ® Zn(NO3)2 + 2H2O + 2NO2
4) Khử một số oxit kim loại ( dùng C, CO, ...)
C + 2CuO CO2 + 2Cu
5) Dùng các phản ứng tạo sản phẩm không bền:
Ví dụ : CaCO3 + 2HCl ® CaCl2 + H2O + CO2
4
Bazơ KT
+ ) Muối + kiềm ® muối mới + Bazơ mới.
5
Bazơ tan
1 ) Kim loại + nước ® dd bazơ + H2
2) Oxit bazơ + nước ® dung dịch bazơ.
3 ) Điện phân dung dịch muối clrorua, bromua.
2NaCl + 2H2O 2NaOH + H2 + Cl2
4) Muối + kiềm ® muối mới + Bazơ mới.
6
Axit
1) Phi kim + H2 ® hợp chất khí (tan / nước ® axit).
2) Oxit axit + nước ® axit tương ứng.
3) Axit + muối ® muối mới + axit mới.
4) Cl2, Br2+ H2O ( hoặc các hợp chất khí với hiđro).
7
Muối
1) dd muối + dd muối ® 2 muối mới.
2) Kim loại + Phi kim ® muối.
3) dd muối + kiềm ® muối mới + Bazơ mới.
4 ) Muối + axit ® muối mới + Axit mới.
5 ) Oxit bazơ + axit ® muối + Nước.
6) Bazơ + axit ® muối + nước.
7) Kim loại + Axit ® muối + H2 ( kim loại trước H ).
8) Kim loại + dd muối ® muối mới + Kim loại mới.
9) Oxit bazơ + oxit axit ® muối ( oxit bazơ phải tan).
10) oxit axit + dd bazơ ® muối + nước.
11) Muối Fe(II) + Cl2, Br2 ® muối Fe(III).
12) Muối Fe(III) + KL( Fe, Cu) ® muối Fe(II).
13) Muối axit + kiềm ® muối trung hoà + nước.
14) Muối Tr.hoà + axit tương ứng ® muối axit.
II- BÀI TẬP ÁP DỤNG VÀ NÂNG CAO
1) Từ Cu và các chất tuỳ chọn, em hãy nêu 2 phương pháp trực tiếp và 2 phương pháp gián tiếp điều chế CuCl2 ? Viết các phương trình phản ứng xảy ra ?
Hướng dẫn:
C1: Cu + Cl2 CuCl2
C2: Cu + 2FeCl3 ® FeCl2 + CuCl2
C3: 2Cu + O2 2CuO
CuO + 2HCl ® CuCl2 + H2O
C4: Cu + 2H2SO4 đặc ® CuSO4 + 2H2O + SO2
CuSO4 + BaCl2 ® CuCl2 + BaSO4 ¯
2) Từ các nguyên liệu là : Pyrit ( FeS2), muối ăn , nước và các chất xúc tác. Em hãy viết các phương trình điều chế ra : Fe2(SO4)3 , Fe(OH)3 và Fe(OH)2.
3) Từ CuCl2, dung dịch NaOH, CO2. Viết phương trình hóa học điều chế CaO, CaCO3.
4) Từ các dung dịch : CuSO4, NaOH , HCl, AgNO3 có thể điều chế được những muối nào ? những oxit bazơ nào ? Viết các phương trình hóa học để minh họa.
5) a) Từ các chất : Al, O2, H2O, CuSO4(r), Fe, ddHCl. Hãy viết các phương trình hóa học điều chế: Cu, Al2(SO4)3, AlCl3, FeCl2. ( Tất cả các chất nguyên liệu phải được sử dụng).
b) Từ các chất : Na2O, CuO, Fe2O3, H2O, H2SO4 . Hãy viết phương trình hóa học điều chế : NaOH, Fe(OH)3, Cu(OH)2.
6) Từ mỗi chất: Cu, C, S, O2, H2S, FeS2, H2SO4, Na2SO3, hãy viết các PTHH điều chế SO2
7) Từ không khí, nước, đá vôi, quặng Pirit sắt, nước biển. Hãy điều chế : Fe(OH)3, phân đạm 2 lá NH4NO3, phân đạm urê : (NH2)2CO
4NH3 + 5O2 4NO + 6H2O
NO + ½ O2 ® NO2
2NO2 + ½ O2 + H2O ® 2HNO3
HNO3 + NH3 ® NH4NO3
Hướng dẫn :
KK lỏng N2 + O2
CaCO3 CaO + CO2
2H2O 2H2 + O2
N2 + 3H2 2NH3
2NH3 + CO2 ® CO(NH2)2 + H2O
8) Từ hỗn hợp MgCO3, K2CO3, BaCO3 hãy điều chế các kim loại Mg, K và Ba tinh khiết.
Hướng dẫn :
- Hoà tan hỗn hợp vào trong nước thì K2CO3 tan còn BaCO3 và CaCO3 không tan.
- Điều chế K từ dung dịch K2CO3 :
K2CO3 + 2HCl ® 2KCl + H2O + CO2
2KCl 2K + Cl2
- Điều chế Mg và Ca từ phần không tan MgCO3 và CaCO3
* Nung hỗn hợp MgCO3 và CaCO3 :
9) Phâ ... O + SO2 ( trong FeS : hóa trị S là -2 )
c) Al + HNO3 ® Al(NO3)3 + N2O + H2O
d) Fe + H2SO4 đặc nóng ® Fe2(SO4)3 + H2O + SO2
e) Al + HNO3 ® Al(NO3)3 + H2O + NH4NO3 ( xem N trong NH4NO3 có hóa trị I )
g) FexOy + H2SO4 đặc nóng ® Fe2(SO4)3 + H2O + SO2
h) FexCuy Sz + O2 Fe2O3 + CuO + SO2
Hướng dẫn câu 4b:
® + ( tăng 7 )
® ( giảm 2)
Tổng hợp ta có : 2FeS + 7H2SO4 ® Fe2(SO4)3 + 9SO2
Bù 3(SO4) cho vế trái và cân bằng H2O ta được:
2FeS + 10H2SO4 ® Fe2(SO4)3 + 9SO2 + 10H2O
5) Hòa tan a gam một oxit sắt FexOy vào trong dung dịch H2SO4 đặc nóng dư thì thu được khí SO2 duy nhất.Mặt khác, nếu khử hoàn toàn a gam oxit sắt trên bằng khí CO, hòa tan lượng sắt tạo thành trong dung dịch H2SO4 đặc nóng (dư) thu được lượng SO2 gấp 9 lần lượng SO2 ở thí nghiệm trên.
a) Viết các phương trình phản ứng xảy ra trong hai thí nghiệm trên.
b) Xác định định công thức hóa học của oxit sắt.
Hướng dẫn :
2FexOy + (6x -2y )H2SO4 ( đặc) xFe2(SO4)3 + (3x-2y) SO2 + (6x -2y )H2O (1)
a (mol) ® (mol)
Fe xOy + yH2 xFe + yH2O (2)
a (mol) ® ax (mol)
2Fe + 6H2SO4 ( đặc) Fe2(SO4)3 + 3SO2 + 6H2O (3)
ax (mol) ® 1,5 ax ( mol)
Theo đề bài : nên ta có :
Þ Þ CTPT của oxit sắt là : Fe3O4.
6) Hòa tan một lượng oxit sắt FexOy vào dung dịch HNO3 loãng, dư thì thu được một dung dịch A và khí NO duy nhất. Mặt khác nếu khử lượng oxit sắt trên bằng lượng CO dư rồi lấy toàn bộ kim loại sinh ra hòa tan hoàn toàn trong dung dịch HNO3 đặc, nóng thì thu được dung dịch B và khí NO2 duy nhất. Biết thể tích khí NO2 sinh ra gấp 9 lần thể tích khí NO sinh ra ( cùng nhiệt độ, áp suất).
a) Viết các phương trình hóa học.
b) Xác định công thức hóa học của oxit sắt.
Hướng dẫn :
Đối với pư (1) : xFe : tăng (3x – 2y ) ( là phần HT tăng của x ng.tử Fe )
N: giảm 3
Chú ý: hóa trị Fe tăng thêm : 3 – =
3FexOy + (12x -2y )HNO3 3xFe(NO3)3 + (3x - 2y)NO + (6x-y) H2O (1)
a (mol) ® (mol)
Fe xOy + yCO xFe + yCO2 (2)
a (mol) ® ax (mol)
Fe + 6HNO3 Fe(NO3)3 + 3NO2 + 3H2O (3)
ax (mol) ® 3ax ( mol)
Theo đề bài ta có :
Vậy CTPT của oxit sắt là: FeO.
--------------------------------
Chủ đề 9: BIỆN LUẬN KHẢ NĂNG XẢY RA CỦA PHẢN ỨNG
I- KIẾN THỨC CẦN NHỚ
1) Nguyên tắc :
- Đề bài thường cho các lượng chất dạng chữ (a,b,c...) và yêu cầu tìm quan hệ toán học giữa các dữ kiện để phản ứng xảy ra theo nhiều khả năng khác nhau. Thường gặp các dạng sau:
* Oxit axit ( hoặc đa axit ) tác dụng với kiềm tạo muối khác nhau.
* Muối của kim loại lưỡng tính tác dụng với kiềm tạo kết tủa min hoặc max khác nhau.
* Một kim loại tác dụng với dd chứa nhiều muối ( hoặc một dung dịch muối tác dụng với hỗn hợp kim loại ) thu được số lượng muối và kim loại khác nhau.
* Muối aluminat( gốc : – AlO2 ), zincat (gốc := ZnO2 ) tác dụng với axit ( HCl, H2SO4 ) tạo kết tủa min hoặc max khác nhau.
2) Các ví dụ:
Ví dụ 1: Cho từ từ dd chứa x ( mol ) HCl vào dung dịch chứa y ( mol ) NaAlO2 thì:
- Đầu tiên, HCl thiếu nên có kết tủa Al(OH)3 và cực đại khi NaAlO2 hết ( x mol )
NaAlO2 + HCl + H2O ® NaCl + Al(OH)3 ¯ (1)
- Sau đó, HCl bắt đầu tác dụng với Al(OH)3 làm tan kết tủa
Al(OH)3 + 3HCl ® AlCl3 + 3H2O (1’)
NaAlO2 + 4HCl ® NaCl + AlCl3 + 2H2O (2)
Vậy khi cho NaAlO2 tác dụng với dd HCl thì có thể xảy ra ( 1) hoặc (2) hoặc đồng thời cả hai.
Đặt thì kết quả tạo sản phẩm như sau:
+ ) Nếu T = 1 (x = y) Þ chỉ xảy ra (1) : vừa đủ ( kết tủa max).
+ ) Nếu T < 1 (x < y) Þ chỉ xảy ra (1) : dư NaAlO2 .
+ ) Nếu T = 4 (x = 4y) Þ chỉ xảy ra ( 2) : vừa đủ ( kết tủa tan hoàn toàn ).
+ ) Nếu T > 4 (x > 4y) Þ chỉ xảy ra ( 2 ) : HCl dư ( kết tủa tan hoàn toàn ).
+ ) Nếu 1 < T < 4 (y <x <4y) Þ xảy ra (1), (2) : vừa đủ ( kết tủa chưa cực đại ).
Ví dụ 2: Cho a (mol) Mg vào dd chứa b (mol) Cu(NO3)2 và b (mol) Al(NO3)3 thì thứ tự xảy ra các phản ứng sau:
Mg + Cu(NO3)2 ® Mg(NO3)2 + Cu ¯ (1)
3Mg + 2Al(NO3)3 ® 3Mg(NO3)2 + 2Al ¯ (2)
+) Nếu a < b thì chỉ xảy ra (1) Þ sau pư có : 3 muối là Mg(NO3)2 ; Al(NO3)3 , Cu(NO3)2 và 1 kim loại là Cu.
+) Nếu a = b thì chỉ xảy ra (1) Þ sau pư có : 2 muối Mg(NO3)2 ; Al(NO3)3 và 1 kim loại Cu.
+) Nếu b < a < b + 1,5c thì (1) đã kết thúc, (2) chưa kết thúc Þ sau pư có : 2 muối Mg(NO3)2 , Al(NO3)3 và 2 kim loại.
+) Nếu a = b + 1,5c thì vừa đủ xảy ra (1) và (2) Þ sau pư có : 1 muối là Mg( NO3)2 và 2 kim loại là Cu, Al.
+) Nếu a > b + 1,5c thì đã xảy ra (1) và (2) Þ sau pư có 1 muối Mg(NO3)2 và 3 kim loại.
II- BÀI TẬP ÁP DỤNG VÀ NÂNG CAO
1) Cho a mol CO2 tác dụng với dung dịch chứa b (mol) Ca(OH)2 . Hãy lập luận xác định tương quan giữa a và b để sau phản ứng thu được 1 muối , hai muối. ( Làm tương tự đối với b mol NaOH.).
Hướng dẫn :
Các phương trình hóa học có thể xảy ra:
Ca(OH)2 + CO2 ® CaCO3 ¯ + H2O (1)
Ca(OH)2 + 2CO2 ® Ca(HCO3)2 (2)
Đặt T =
- Nếu tạo muối CaCO3 thì T £ 1 Þ a £ b.
- Nếu tạo muối Ca(HCO3)2 thì T ³ 1 Þ b £ Û a ³ 2b.
- Nếu tạo ra cả 2 muối thì : 1 < T < 2 Þ < b < a ( hay a < a < 2b ).
2) Cho dung dịch chứa a (mol) NaOH tác dụng với b (mol) P2O5. Hãy luận luận xác định muối tạo thành theo sự tương quan giữa a và b. Áp dụng khi a = 0,2 mol , b = 0,15 mol.
Hướng dẫn :
Các phản ứng xảy ra :
P2O5 + 3H2O ® 2H3PO4 (1)
.b 2b (mol)
H3PO4 + 3NaOH ® Na3PO4 + 3H2O (2)
H3PO4 + 2NaOH ® Na2HPO4 + 2H2O (3)
H3PO4 + NaOH ® NaH2PO4 + H2O (4)
Đặt T =
* Lưu ý : để tạo muối axit thì không dư kiềm và để tạo muối trung hòa thì không dư axit.
- Nếu tạo muối Na3PO4 thì T ³ 3 Û ³ 3 Þ a ³ 6b.
- Nếu tạo ra muối Na2HPO4 thì T = 2 Û = 2 Þ a = 4b.
- Nếu tạo ra muối 2 muối Na2HPO4 và Na3PO4 thì: 2 < T < 3 Þ 4b < a < 6b.
- Nếu tạo ra muối NaH2PO4 thì T £ 1 Û £ 1 Þ a £ 2b.
- Nếu tạo ra 2 muối axit NaH2PO4 và Na2HPO4 thì : 1 < T < 2 Þ 2b < a < 4b.
3) Dung dịch A chứa a mol CuSO4 và b mol FeSO4
-Thí nghiệm 1: Cho c mol Mg vào A ,sau khi phản ứng kết thúc, dung dịch thu được có 3 muối.
-Thí nghiệm 2: Cho 2c mol Mg vào A, sau khi phản ứng kết thúc, dung dịch thu được có 2 muối.
-Thí nghiệm 3: Cho 3c mol Mg vào A, sau khi phản ứng kết thúc, dung dịch thu được có 1 muối.
Tìm mối quan hệ giữa a,b, và c trong mỗi thí nghiệm.
Hướng dẫn:
* Cách 1: Vì Mg > Fe > Cu nên các phản ứng xảy ra theo trình tự như sau :
Mg + CuSO4 ® MgSO4 + Cu ¯
a ¬a
Mg + FeSO4 ® MgSO4 + Fe ¯
b ¬b
TN 1 : Nếu sau phản ứng có 3 muối thì các muối là MgSO4 , FeSO4 ,CuSO4 Þ CuSO4 chưa hết. Þ Û c < a
TN 2: Sau phản ứng có 2 muối thì các muối là : MgSO4 và FeSO4 Þ CuSO4 đã hết và FeSO4 chưa hết . Þ Û a £ 2c < a + b
TN 3: Sau phản ứng chỉ có 1 muối MgSO4 thì cả hai muối ban đầu đã phản ứng hết .
Þ Û 3c ³ a+b
* Cách 2:
TN 1: Vì dung dịch thu được có 3 muối. Vậy có các ptpư
Mg + CuSO4 ® Cu + MgSO4
c a ( ta có: a > c )
TN 2: Dung dịch thu được gồm 2 muối .Vậy ta có các PTHH:
Mg + CuSO4 ® Cu + MgSO4
a a
Mg + FeSO4 ® Fe + MgSO4
(2c – a) b (mol)
Ta có : 2c ³ a và b > 2c – a vậy : a £ 2c < a + b
TN 3: Dung dịch thu được có một muối. Vậy thứ tự các PTHH :
Mg + CuSO4 ® Cu + MgSO4
a a
Mg + FeSO4 ® Fe + MgSO4
(3c – a) b (mol)
Ta có : 3c – a ³ b
4) Cho x (mol) NaAlO2 tác dụng với dung dịch chứa y (mol) HCl.
a) Viết phương trình hóa học có thể xảy ra.
b) Hãy lập tỷ lệ để sau phản ứng thu được kết tủa ? hoặc không có kết tủa? Hoặc kết tủa cực đại.
Hướng dẫn:
a) Các phương trình phản ứng xảy ra:
NaAlO2 + HCl + H2O ® Al(OH)3 ¯ + NaCl (1)
Sau đó ( nếu dư HCl )
Al(OH)3 + 3HCl ® AlCl3 + 3H2O (1’)
Tổng hợp (1) và (1’) ta có pư ( khi kết tủa tan hoàn toàn )
NaAlO2 + 4HCl ® AlCl3 + NaCl + 2H2O (2)
Vậy khi cho NaAlO2 tác dụng với HCl thì hoặc xảy ra (1),(2) hoặc cả hai.
Đặt T = , theo các pư (1) và (2) ta có :
- Nếu không có kết tủa xuất hiện thì T ³ 4 hay ³ 4 Þ
- Nếu thu được kết tủa thì T < 4 hay < 4 Þ
- Để đạt kết tủa cực đại thì T = 1 hay = 1 Þ
5) Cho rất từ từ dung dịch A ( chứa a mol HCl ) vào dung dịch B ( chứa b mol Na2CO3 ). Hãy lập luận xác định quan hệ giữa a và b để phản ứng không có khí ? có khí ? có khí cực đại ?
Hướng dẫn :
Đầu tiên : Na2CO3 dư nên không có khí bay ra.
Na2CO3 + HCl ® NaHCO3 + NaCl (1)
Khi HCl dư thì: có khí bay ra:
NaHCO3 + HCl ® NaCl + H2O + CO2 (1’)
Ta có pư chung: Na2CO3 + 2HCl ® NaCl + H2O + CO2 (2)
* Để không có khí thì chỉ xảy ra (1) : a £ b.
* Để có khí bay ra thì a > b.
* Để thu được lượng khí lớn nhất thì a ³ 2b { tức lượng Na2CO3 pư hết ở (2) }.
6) Cho a (mol) AlCl3 tác dụng với dung dịch chứa b mol NaOH. Viết phương trình hóa học xảy ra và xác định quan hệ giữa a và b để sau phản ứng : thu được kết tủa hoặc không thu được kết tủa hoặc kết tủa cực đại.
Hướng dẫn:
Các ptpư :
AlCl3 + 3NaOH ® Al(OH)3 ¯ + 3NaCl (1)
Nếu NaOH dư so với AlCl3 thì :
Al(OH)3 + NaOH ® NaAlO2 + 2H2O (1’)
Tổng hợp : AlCl3 + 4NaOH ® NaAlO2 + 3NaCl + 2H2O (2)
Đặt T =
Để không có kết tủa thì T ³ 4 Þ b ³ 4b
Để có kết tủa thì T < 4 Þ b < 4a
Để có kết tủa cực đại thì T = 3 Þ b = 3a
7) Cho hỗn hợp gồm x (mol) Fe và y (mol) Al vào dung dịch chứa z (mol) AgNO3 thì thu được dung dịch A và rắn B. Xác định quan hệ giữa x,y,z thỏa mãn các điều kiện sau:
a) Rắn B gồm 3 kim loại.
b) Rắn B gồm 2 kim loại.
c) Rắn B gồm 1 kim loại.
Hướng dẫn:
Vì Al > Fe > Ag nên thứ tự các phản ứng như sau:
Al + 3AgNO3 ® Al(NO3)3 + 3Ag ¯ (1)
.y ® 3y (mol)
Fe + 2AgNO3 ® Fe(NO3)2 + 2Ag ¯ (1)
.x ® 2x (mol)
a) Nếu rắn B gồm 3 kim loại : (Al,Fe,Ag ) thì pư ở (1) Al dư : z < 3y
b) Nếu rắn B gồm 2 kim loại : (Fe, Ag) thì Fe còn dư hoặc chưa phản ứng :
3y £ z < 3y + 2x
c) Nếu rắn B gồm 1 kim loại : Fe hết ® z ³ 3y + 2x
8) Dung dịch M có chứa CuSO4 và FeSO4.
a) Cho Al vào dung dịch M. Sau khi phản ứng kết thúc thu được dung dịch A chứa 3 muối tan.
b) Cho Al vào dung dịch M. Sau khi phản ứng kết thúc thu được dung dịch B chứa 2 muối tan.
c) Cho Al vào dung dịch M. Sau khi phản ứng kết thúc thu được dung dịch C chứa 1 muối tan.
Giải thích mỗi trường hợp và viết phương trình hoá học của các phản ứng.
Hướng dẫn :
Độ hoạt động kim loại : Al > Fe > Cu nên thứ tự xảy ra các phan ứng sau :
2Al + 3CuSO4 ® Al2(SO4)3 + 3Cu ( 1)
2Al + 3FeSO4 ® Al2(SO4)3 + 3Fe (2)
a) Nếu dung dịch A gồm 3 muối Al2(SO4)3 , CuSO4 , FeSO4 thì chỉ xảy ra (1) và CuSO4 dư
b) Nếu dung dịch A gồm 2 muối Al2(SO4)3 ; FeSO4 thì FeSO4 chưa phản ứng hoặc đã tham gia pư (2) nhưng chưa hết.
c) Nếu dung dịch A chỉ chứa 1 muối Al2(SO4)3 thì CuSO4 và FeSO4 đã pư hết ở pư (1) và (2). Do lượng Al lấy vào vừa đủ hoặc dư.
9) Cho rất từ từ dung dịch X ( chứa a mol HCl ) vào dung dịch Y chứa b mol K2CO3. Sau khi cho hết X vào Y thì thu được dung dịch Z. Hãy xác định các chất tạo thành và số mol của nó trong dung dịch Z ( tính theo a và b ).
--------------------------
Tài liệu đính kèm:
 CHUYEN DE ON HSG HOA 9.doc
CHUYEN DE ON HSG HOA 9.doc





