Đề kiểm tra học kì I năm học 2011 – 2012 môn : Hóa học lớp 9 - Thời gian 45 phút
Câu 1 : Chất nào sau đây được dùng làm nguyên liệu ban đầu để sản xuất H2SO4 trong công nghiệp?
A. SO2 B. SO3 C. FeS2 D. FeS
Câu 2 : Dãy nào sau đây chỉ gồm các kim loại đều phản ứng với dung dịch CuSO4
A. Na; Al; Cu; Ag B. Al; Fe; Mg; Cu
C. Na; Al; Fe; K D. K; Mg; Ag; Fe
Bạn đang xem tài liệu "Đề kiểm tra học kì I năm học 2011 – 2012 môn : Hóa học lớp 9 - Thời gian 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
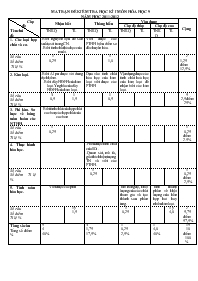
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I MÔN HÓA HỌC 9 NĂM HỌC 2011-2012 Cấp độ Tên chủ đề Nhận biết Thông hiểu Vận dụng Cộng Cấp độ thấp Cấp độ cao TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. Các loại hợp chất vô cơ. -Biết nguyên liệu để sản xuất axit trong CN. -Biết tính chất hóa học của muối. Viết được các PTHH biểu diễn sơ đồ chuyển hóa. Số câu Số điểm Tỉ lệ % 1 0,25 1 1,0 2 1,25 điểm 12,5 % 2. Kim loại. -Biết Al pư được với dung dịch kiềm. -Biết dãy HĐHH của kim loại. Ý nghĩa của dãy HĐHH của kim loại. Dựa vào tính chất hóa học của kim loại viết được các PTHH Vận dụng được các tính chất hoá học của kim loại để nhận biết các kim loại. Số câu Số điểm Tỉ lệ % 3 0,5 1 1,5 1 0,5 5 2,5 điểm 25% 3. Phi kim. Sơ lược về bảng tuần hoàn các NTHH. Biết tính chất của hợp chất cacbon, các hợp chất của cacbon. Số câu Số điểm Tỉ lệ % 1 0,25 1 0,25 điểm 2.5% 4. Thực hành hóa học. -Hiểu được tính chất của SO2. -Quan sát, mô tả, giải thích hiện tượng TN và viết các PTHH. Số câu Số điểm Tỉ lệ % 1 0,25 1 0,25 điểm 2,5% 5. Tính toán hóa học. Viết được các phtt Tìm nồng độ, khối lượng của các chất tham gia và tạo thành sau phản ứng. Tính thành phần về khối lượng của hỗn hợp hai hay nhiều kim loại. Số câu Số điểm Tỉ lệ % 1 ý 1,5 1 0,25 1 ý 4,0 2 5,75 điểm 57,5% Tổng số câu Tổng số điểm % 5 4 40% 3 1,75 17,5% 1 0,25 2,5% 1 4,0 40% 15 10 điểm 100% ĐỀ KIỂM TRA HỌC KÌ I NĂM HỌC 2011 – 2012 MÔN : HÓA HỌC LỚP 9 - Thời gian 45 phút I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (2 điểm): Hãy khoanh tròn chữ cái A hoặc B, C, D đứng trước câu trả lời đúng: Câu 1 : Chất nào sau đây được dùng làm nguyên liệu ban đầu để sản xuất H2SO4 trong công nghiệp? A. SO2 B. SO3 C. FeS2 D. FeS Câu 2 : Dãy nào sau đây chỉ gồm các kim loại đều phản ứng với dung dịch CuSO4 A. Na; Al; Cu; Ag B. Al; Fe; Mg; Cu C. Na; Al; Fe; K D. K; Mg; Ag; Fe Câu 3 : Dãy gồm các kim loại được sắp theo chiều tăng dần về hoạt động hóa học là A. Na; Al; Fe; Cu; K; Mg B. Cu; Fe; Al; K; Na; Mg C. Fe; Al; Cu; Mg; K; Na D. Cu; Fe; Al; Mg; Na; K Câu 4 : Cho dây nhôm vào dung dịch NaOH đặc, hiện tượng hóa học quan sát được ngay là A. Không có hiện tượng gì xảy ra B. Sủi bọt khí mạnh C. Khí màu nâu xuất hiện D. Dung dịch chuyển sang màu hồng Câu 5 : Khí cacbonic tăng lên trong khí quyển là một nguyên nhân gây nên hiệu ứng nhà kính (hiện tượng nóng lên toàn cầu). Nhờ quá trình nào sau đây kìm hãm sự tăng khí cacbonic? A. Quá trình nung vôi B. Nạn cháy rừng C. Sự đốt cháy nhiên liệu D. Sự quang hợp của cây xanh Câu 6 : Cặp chất nào sau đây có phản ứng tạo thành sản phẩm là chất khí A. Dung dịch Na2CO3 và dung dịch HCl B. Dung dịch Na2SO4 và dung dịch BaCl2 C. Dung dịch KOH và dung dịch MgCl2 D. Dung dịch KCl và dung dịch AgNO3 Câu 7 : Hòa tan 6,2 g Na2O vào nước được 2 lít dung dịch A. Nồng độ mol/l của dung dịch A là A. 0,05M B. 0,01M C. 0,1M D. 1M Câu 8 : Sau thí nghiệm điều chế và thử tính chất của khí Cl2 trong giờ thực hành thí nghiệm, cần phải khử khí độc hại này còn dư. Chất nào sau đây được tẩm vào bông để ngang nút miệng ống nghiệm sau khi làm thí nghiệm là tốt nhất A. dd Muối ăn B. Cồn (ancol etylic) C. dd Dấm ăn D. Xút II. PHẦN TỰ LUẬN (8 điểm): Câu 9 : (1,0 điểm) Viết các phương trình hóa học thực hiện dãy biến đổi hóa học theo sơ đồ sau: Na Na2O NaOH NaCl NaNO3 Câu 10 : (1,5 điểm) Có 3 kim loại màu trắng Ag, Al, Mg. Hãy nêu cách nhận biết mỗi kim loại bằng phương pháp hóa học. Các dụng cụ hóa chất coi như có đủ. Câu 11 : (5,5 điểm) Cho 12,5 g hỗn hợp bột các kim loại nhôm, đồng và magie tác dụng với HCl (dư). Phản ứng xong thu được 10,08 lít khí (đktc) và 3,5 g chất rắn không tan. a) Viết các phương trình hóa học của phản ứng xảy ra. b) Tính thành phần khối lượng mỗi kim loại có trong hỗn hợp. (cho: Al = 27; Mg = 24; Cu = 64) HƯỚNG DẪN CHẤM MÔN HÓA HỌC LỚP 9 KIỂM TRA HỌC KÌ I NĂM HỌC 2011 – 2012 I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (2 điểm): (0,25 điểm/câu) Câu 1 2 3 4 5 6 7 8 Trả lời C C D B D A C D II. PHẦN TỰ LUẬN (8 điểm): Câu Đáp án Biểu điểm 9 (2,0 điểm) Các phương trình phản ứng: 1) 4Na + O2 2Na2O 0,25 2) Na2O + H2O 2NaOH 0,25 3) NaOH + HCl NaCl + H2O 0,25 4) NaCl + AgNO3 NaNO3 + AgCl 0,25 10 (1,5 điểm) - Dùng dung dịch kiềm nhận biết nhôm, tan và có khí không màu thoát ra. 0, 5 - Dùng dung dịch HCl phân biệt 2 kim loại Mg và Ag. Mg tan và có khí thoát ra còn Ag không tan. Mg + 2HCl MgCl2 + H2 0,5 0, 5 11 (5,5 điểm) Cu là kim loại yếu không tác dụng với dung dịch HCl. 0,25 a) 2Al + 6HCl 2AlCl3 + 3H2 0, 5 Mg + 2HCl MgCl2 + H2 0, 5 Chất rắn không tan là Cu. KL Cu = 3,5 (g). 0, 5 b) Khối lượng 2 kim loại Mg và Al trong hỗn hợp: m(Mg,Al) = 12,5 – 3,5 = 9 (g) 0,5 Đặt x, y lần lượt là số mol Mg, Al trong hỗn hợp. 0,25 m(Mg + Al) = 24x + 27y = 9 (1) 0, 5 = 0,45 (mol) 0,25 Mg + 2HCl MgCl2 + H2 x mol x mol 0,5 2Al + 6HCl 2AlCl3 + 3H2 y mol 1,5y mol 0,5 Tổng số mol khí H2 là: = x + 1,5y = 0,45 (mol) (2) 0, 5 Giải hệ phương trình (1) , (2) cho: x = 0,15 và y = 0,2 0,25 = 0,2.27 = 5,4 (g) và = 9 – 5,4 = 3,6 (g) 0,5 (Mọi cách giải khác nếu đúng đều đạt điểm tối đa) BỘ PHẬN CHUYÊN MÔN DUYỆT NGƯỜI RA ĐỀ LÊ TUẤN KHANH
Tài liệu đính kèm:
 de thi hk1 hoa 9.doc
de thi hk1 hoa 9.doc





